- Start
- Kontakt
- Shop
- Seltene Erden
- Produkte
- Gallium
- Indium
- Germanium
- Gainstan
- Fieldsches Metall
- Bismut-Zinn-Eutektikum
- Indium-Bismut-Eutektikum
- Bismut
- Zinn
- Rhenium
- Osmium
- Tantal
- Ceroxid
- Erbiumoxid
- Terbiumoxid
- Samariumoxid
- Lanthanoxid
- Holmiumoxid
- Neodymoxid
- Ytterbiumoxid
- Thuliumoxid
- Dysprosiumoxid
- Lutetiumoxid
- Praseodymoxid
- Yttriumoxid
- Europiumoxid
- Gadoliniumoxid
- Scandiumoxid
- Referenzen
- Ankauf
- International Customers
Osmium
Osmium (76) [Os]
Chemische Formel: Os
Ordnungszahl: 76
Serie: Übergangsmetalle
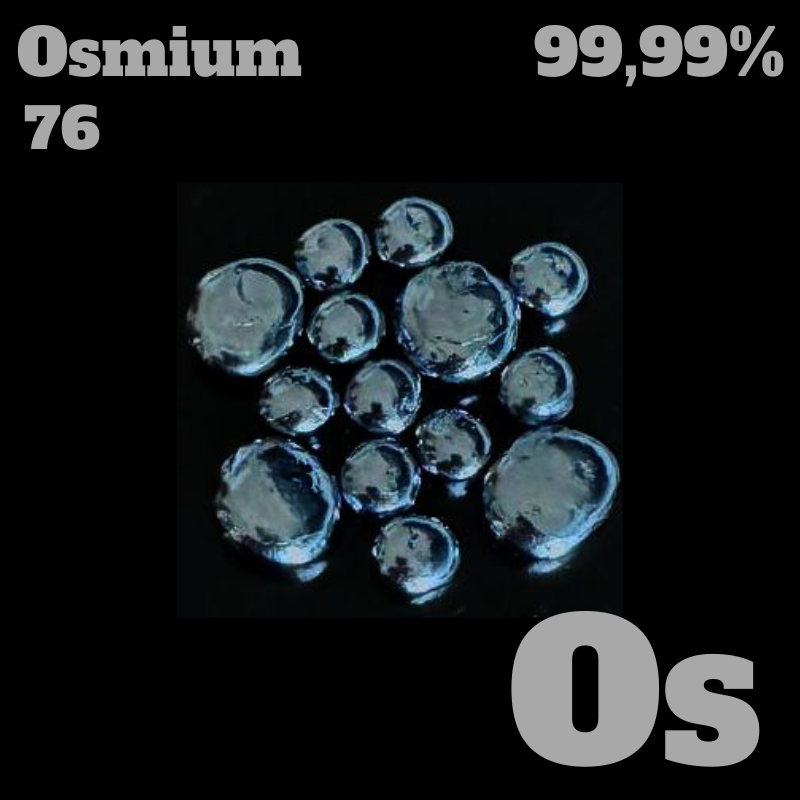
Aussehen: silbrig-blau, glänzend
Masseanteil Erdhülle: ca. 0,0018 ppm
Aggregatszustand: fest
Dichte: 22,59 g·cm⁻³
Schmelzpunkt: 3033 °C
Siedepunkt: ca. 5012 °C
Mohshärte: 7,0
Molares Volumen: 8,42 · 10⁻⁶ m³/mol
Schmelzwärme: ca. 31 kJ/mol
Verdampfungswärme: ca. 738 kJ/mol
CAS: 7440-04-2 Internationale Bezeichnung: 鋨, Осмий, Όσμιο, أوزميوم, Osmio, Osmiyum, Osmium, Os, Ósmio
Ordnungszahl: 76
Serie: Übergangsmetalle
Aussehen: silbrig-blau, glänzend
Masseanteil Erdhülle: ca. 0,0018 ppm
Aggregatszustand: fest
Dichte: 22,59 g·cm⁻³
Schmelzpunkt: 3033 °C
Siedepunkt: ca. 5012 °C
Mohshärte: 7,0
Molares Volumen: 8,42 · 10⁻⁶ m³/mol
Schmelzwärme: ca. 31 kJ/mol
Verdampfungswärme: ca. 738 kJ/mol
CAS: 7440-04-2 Internationale Bezeichnung: 鋨, Осмий, Όσμιο, أوزميوم, Osmio, Osmiyum, Osmium, Os, Ósmio
GHS Gefahrenstoffkennzeichnung:
H: 228-315-318-335
P: 210-280-305+351+338-310
H: 228-315-318-335
P: 210-280-305+351+338-310
EU-Gefahrenstoffkennzeichnung:
R: 11-36/37/38
S: 16-26-36
R: 11-36/37/38
S: 16-26-36
|
|
Geschichte
Osmium wurde 1803 von den britischen Chemikern Smithson Tennant und William Hyde Wollaston in London entdeckt.
Sie isolierten das Element aus Platinerzen, die in Säure gelöst wurden. Tennant benannte es nach dem griechischen Wort „osme“ (Geruch), da Osmiumtetroxid (OsO₄), ein bei der Reaktion entstehendes Nebenprodukt, einen starken, unangenehmen Geruch aufweist.
Sie isolierten das Element aus Platinerzen, die in Säure gelöst wurden. Tennant benannte es nach dem griechischen Wort „osme“ (Geruch), da Osmiumtetroxid (OsO₄), ein bei der Reaktion entstehendes Nebenprodukt, einen starken, unangenehmen Geruch aufweist.
Osmium war eines der letzten Platingruppenmetalle, das identifiziert wurde, und seine Entdeckung trug zur Vervollständigung des Periodensystems bei.
Physikalische und Chemische Eigenschaften
Osmium ist ein extrem dichtes, silbrig-blaues Metall und das dichteste natürlich vorkommende
Element.
Es ist sehr hart, spröde und schwer zu bearbeiten. Osmium hat einen extrem hohen Schmelzpunkt von 3033 °C und ist wie auch
andere Edelmetalle beständig gegen Korrosion, selbst bei hohen Temperaturen. An der Luft bildet es in feiner Pulverform bei Raumtemperatur langsam Osmiumtetroxid (OsO₄), das hochgiftig, flüchtig
und stark ätzend ist. Osmium reagiert kaum mit verdünnten Säuren, wird aber von oxidierenden Säuren wie Salpetersäure angegriffen.
Mit Halogenen bildet Osmium Verbindungen wie Osmiumtetrafluorid (OsF₄) oder Osmiumhexafluorid (OsF₆). Es zeigt
Ähnlichkeiten mit anderen Platingruppenmetallen wie Platin oder Iridium. Beim Erhitzen in reinem Sauerstoff kann es brennen und bildet dabei das gefährliche Osmiumtetroxid. Osmiumkristalle, die
bei langsamer Abkühlung entstehen, sind oft hexagonal und glänzend.
Verwendung
Aufgrund seiner Seltenheit, Toxizität und schwierigen Verarbeitung wird Osmium nur in speziellen Anwendungen
genutzt:
- Legierungen: Osmium wird in extrem harten Legierungen mit anderen Platingruppenmetallen (z. B. Iridium) verwendet, z. B. für Füllfederhalterspitzen, Lager oder elektrische Kontakte.
- Katalysator: Osmiumverbindungen, insbesondere Osmiumtetroxid, dienen in der organischen Chemie als Katalysatoren, z. B. bei der Dihydroxylierung von Alkenen.
- Wissenschaftliche Anwendungen: Aufgrund seiner Dichte wird Osmium in der Materialforschung und als Standard in der Dichtemessung verwendet.
- Schmuck: In reiner Form wird Osmium zunehmend für hochwertigen Schmuck verwendet, da es durch spezielle Kristallisationsverfahren in glänzender Form verarbeitet werden kann und ungefährlich ist.
Toxikologie und Gefahren
Osmiummetall selbst ist relativ ungiftig, aber Osmiumtetroxid (OsO₄) ist hochgiftig, ätzend und flüchtig. Es kann schwere
Augen-, Atemwegs- und Hautschäden verursachen und ist potenziell krebserregend.
Der Kontakt mit Osmiumtetroxid muss unbedingt vermieden werden, da es bereits in geringen Mengen gefährlich ist.
Osmiumpulver ist entzündlich und kann bei feiner Verteilung in der Luft explosionsfähig sein.
Kristallines Osmium und Schmelzperlen sind dagegen ungefährlich.
Osmium sollte getrennt von anderen Materialien gelagert werden, da es durch die Bildung von Osmiumtetroxid andere
Substanzen kontaminieren kann. In der Umwelt ist Osmium aufgrund seiner Seltenheit kaum relevant, aber die Handhabung erfordert strikte Sicherheitsvorkehrungen.
